| Last name | First name | Username | View password | Edit profile | |
| Dean | Kusuma | dean4876618 | |||
| Gita | Gutawa | gita4876612 | |||
| Janisa | Charles | janisa4876611 | |||
| Jeandra | Pratama | jeandra4876614 | |||
| keenan | Maisha | keenan4876616 | |||
| Kendra | Rukmana | kendra4876619 | |||
| Masha | Maharani | masha4876617 | |||
| Sarach | Seila | sarach4876615 | |||
| Vegara | pradana | vegara4876613 | |||
| Wagner | William | wagner4876620 | |||
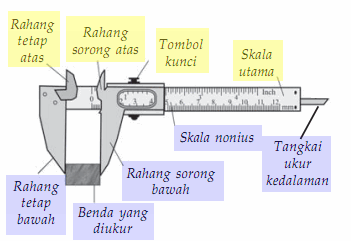
jangka sorong sebagai alat ukur
Replace these every slider sentences with your featured post descriptions.Go to Blogger edit html and find these sentences.Now replace these with your own descriptions.This theme is Bloggerized by Lasantha - Premiumbloggertemplates.com.
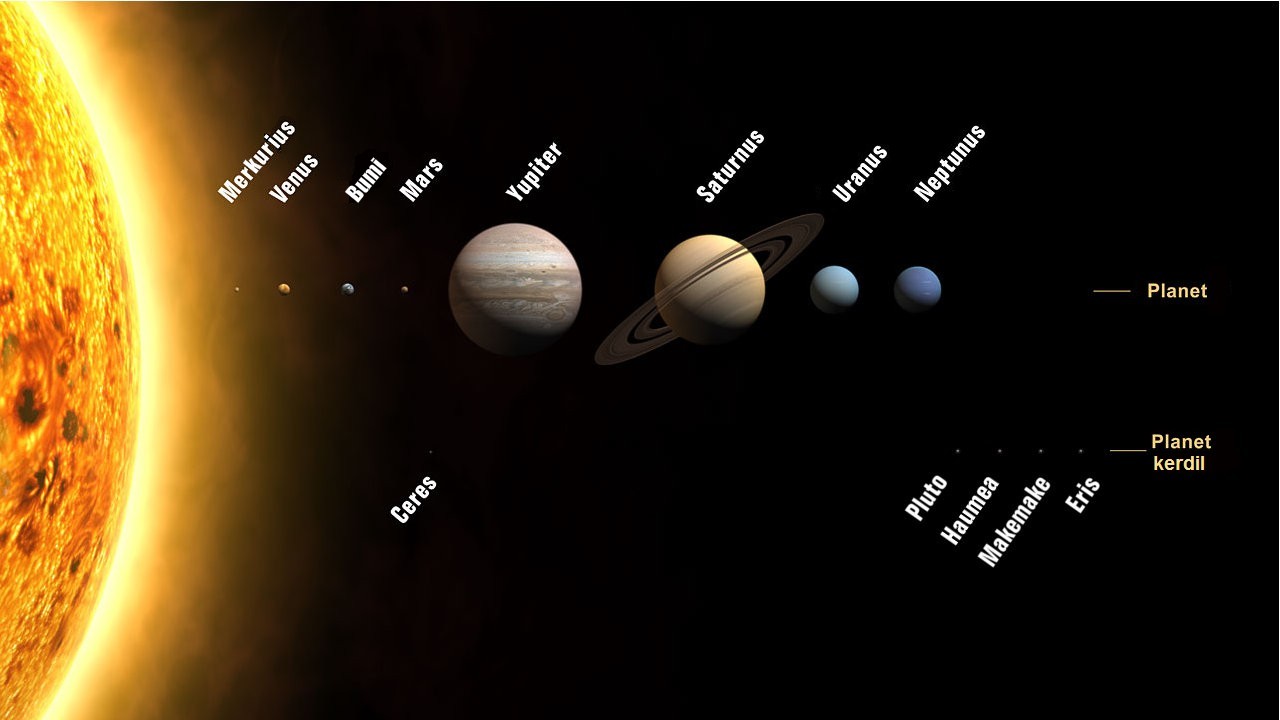
tata surya
Replace these every slider sentences with your featured post descriptions.Go to Blogger edit html and find these sentences.Now replace these with your own descriptions.This theme is Bloggerized by Lasantha - Premiumbloggertemplates.com.
Galaksi Bimasakti
Replace these every slider sentences with your featured post descriptions.Go to Blogger edit html and find these sentences.Now replace these with your own descriptions.This theme is Bloggerized by Lasantha - Premiumbloggertemplates.com.

Senin, 05 Mei 2014
 18.44
18.44
 Unknown
Unknown
ULANGAN HARIAN BAB KALOR
bagi siswa kelas VII A kerjakan ulangan harian bab kalor dengan membuka alamat website http://quizstar.4teachers.org/indexs.jsp dengan pasword p001 dan username dibawah ini :
Selasa, 15 April 2014
Sabtu, 12 April 2014
 04.45
04.45
 Unknown
Unknown
Larutan Asam, Basa, dan Garam Bersifat Elektrolit
Zat-zat yang larut dalam air dan dapat membentuk sifat larutan yang menghantarkan arus listrik dinamakan larutan elektrolit. Demikian juga larutan asam, basa, dan garam. Jika dilarutkan dalam air maka larutan tersebut akan bersifat elektrolit.
Untuk lebih jelasnya perhatikan contoh dari zat yang bersifat asam, basa dan garam jika dilarutkan dalam air akan menjadi sebagai berikut:
Zat yang bersifat asam
Zat asam adalah zat yang jika dimasukkan dalam air melepas ion H+. Sebagai contoh zat yang bersifat asam misalnya asam kloroda (HCl) jika terurai dalam air akan menjadi H+ + Cl- selanjutnya ion H+ akan bereaksi dan bergabung dengan H2O menjadi ion hidronium (H3O+) dan persamaan reaksinya adalah:
H+ + H2O = H3O+
Zat yang bersifat basa
Zat bersifat basa adalah zat yang jika dimasukkan dalam air melepas ion OH- sebagai contoh yang bersifat basa misalnya Natrium hidroksida (NaOH) jika terurai dalam air akan menjadi Na+ + OH- selanjutnya ion OH- akan bereaksi dengan air (H2O) dan persamaan reaksinya menjadi
OH- + H2O = H2O + OH-
Zat yang bersifat garam
Yakni senyawa yang terbentuk dari logam dan non logam yang bergabung dengan ikatan ion. Sebagai contoh garam adalah natrium klorida atau garam dapur NaCl yang terbentuk dari ion Na+ dan Cl-. Dari penjelasan di atas terlihat bahwa zat asam yang dilarutkan dalam air akan terbentuk ion Na+ dan Cl- yang ketiganya adalah ion-ion yang bermuatan sehingga jika ketiga zat tersebut dapat digunakan untuk menghantar listrik yang disebut larutan elektrolit.
 04.32
04.32
 Unknown
Unknown
IDENTIFIKASI SIFAT ASAM BASA DAN GARAM
Banyak sekali larutan di sekitar kita, baik yang bersifat asam, basa, maupun netral. Tahukah kamu bagaimana cara menentukan sifat asam dan basa larutan secara tepat? Indikator yang dapat digunakan untuk menentukan sifat asam dan basa larutan secara tepat adalah indikator asam basa. Apa pengertian indikator?
Indikator adalah zat-zat yang menunjukkan indikasi berbeda dalam larutan asam, basa, dan garam. Cara menentukan senyawa bersifat asam, basa, atau netral dapat menggunakan kertas lakmus dan larutan indikator atau indikator alami. Berikut adalah dua cara menguji sifat larutan yaitu dengan menggunakan indikator buatan (salah satunya dengan mengidentifikasinya dengan kertas lakmus) dan indikator alami.
Identifikasi dengan Kertas Lakmus
Warna kertas lakmus dalam larutan asam, larutan basa dan larutan bersifat netral berbeda. Ada dua macam kertas lakmus, yaitu lakmus merah dan lakmus biru. Sifat dari masing-masing kertas lakmus tersebut adalah sebagai berikut.
1) Lakmus merah dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
2) Lakmus biru dalam larutan asam berwarna merah dan dalam larutan basa berwarna biru.
3) Lakmus merah maupun biru dalam larutan netral tidak berubah warna.
Identifikasi Larutan Asam, Basa dan Garam Menggunakan Indikator Alami
Ada beberapa cara yang dapat lakukan untuk mengetahui apakah zat tersebut tergolong asam, basa atau garam, yaitu dengan menggunakan indikator alami. Berbagai bunga yang berwarna atau tumbuhan dapat digunkan sebagai indikator untuk menentukan asam, basa atau garam suatu zat, misalnya bunga kembang sepatu, bunga mawar, kunyit, kulit manggis, dan kubis ungu.
Sebagai contoh, ambillah kulit manggis, tumbuklah sampai halus dan campur dengan sedikit air. Warna kulit manggis adalah ungu (dalam keadaan netral). Jika ekstrak kulit manggis dibagi tiga dan masing-masing diteteskan larutan asam, basa dan garam, maka dalam larutan asam terjadi perubahan warna dari ungu menjadi cokelat kemerahan. Larutan basa yang diteteskan akan mengubah warna dari ungu menjadi biru kehitaman, sedangkan pada larutan garam tidak berubah warnanya.
 04.24
04.24
 Unknown
Unknown
ASAM, BASA, DAN GARAM
Dalam kehidupan sehari-hari kita sering menggunkan bahan-bahan yang besifat asam, basa maupun garam. Misalnya pada saat kita membuat rujak biasanya menggunakan asam jawa atau cuka sebagai bahannya agar rasanya masam. Asam jawa dan cuka merupakan contoh asam dalam kehidupan sehari-hari yang sering dijumpai.
Kita juga tidak asing dengan sabun, deterjen dan shampo, yang sering kita gunakan sebagai bahan pembersih. Sabun, deterjen dan shampo merupakan salah satu contoh basa dalam kehidupan sehari-hari. Contoh garam adalah garam meja atau garam dapur yang sering digunakan untuk campuran masakan sebagai penyedap. Selain digunakan sebagai bahan penyedap, garam juga bisa digunakan sebagai bahan pengawet makanan. Bagaimanakah sifat-sifat dari asam, basa dan garam?
Asam
Istilah asam (acid) berasal dari bahasa Latin acetum yang berarti cuka. Tentunya Anda sudah tahu bagaimana rasa cuka tersebut. Selain cuka, buah-buahan yang masih muda pada umumnya berasa masam. Sebenarnya rasa masam dalam buah-buahan tersebut disebabkan karena zat kimia yang terkandung di dalamnya yang biasa disebut asam.
 |
| Contoh buah yang mengandung asam. Sumber gambar: Winarsih, et al., 2008. |
Istilah asam dalam ilmu kimia adalah zat yang dapat menghasilkan ion hidrogen (H+) ketika dilarutkan ke dalam air. Asam akan terionisasi menjadi ion hidrogen dan ion sisa asam yang bermuatan negatif. Beberapa asam yang dijumpai dalam kehidupan sehari-hari, seperti ditunjukkan dalam tabel berikut ini.
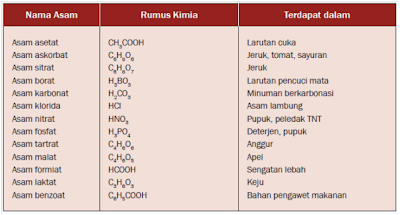 |
Sumber Tabel: Winarsih, et al., 2008
|
Sifat khas lain dari asam adalah dapat bereaksi dengan logam-logam, marmer dan berbagai bahan lain. Logam besi dapat bereaksi cepat dengan asam klorida (HCl) membentuk besi (II) klorida (FeCl2) dan gas hydrogen (H2), berikut rumus reaksi kimianya:
2HCl + Fe FeCl2 + H2
Sifat ini dapat menjelaskan mengapa asam bersifat korosif terhadap sebagian besar logam
Basa
Basa (alkali) berasal dari bahasa Arab yang berarti abu. Istilah basa dalam ilmu kimia adalah zat yang dapat menghasilkan ion hidroksida negatif (OH–) ketika dilarutkan ke dalam larutan air.
 |
| Contoh benda yang mengandung basa dalam kehidupan sehari-hari. Sumber gambar: dikabiounesa.blogspot.com |
Basa dalam kehidupan sehari-hari mudah ditemukan dalam bentuk padat ataupun cairan, seperti kapur tulis, abu, sabun, larutan kapur, detergen, daun sirih, dan lain-lain. Basa terasa pahit dan licin seperti sabun sehingga bersifat kaustik. Beberapa basa yang dijumpai dalam kehidupan sehari-hari, seperti ditunjukkan dalam tabel berikut ini.
Tentunya Anda sekarang sudah tahu kenapa pada zaman dahulu (sebelum adanya pasta gigi) orang-orang kalau membersihkan giginya menggunakan abu yang dikenal dengan nama "abu gosok"?
 |
Sumber tabel: Winarsih, et al., 2008
|
Garam
Garam dalama bahasa Inggrisnya "salt", merupakan hasil reaksi antara asam dengan basa. Apa maksudnya? Pada reaksi kimia, apabila asam direaksikan dengan basa akan menghasilkan garam dan air, reaksi ini disebut reaksi penggaraman.
Beberapa basa yang dijumpai dalam kehidupan sehari-hari, seperti ditunjukkan dalam tabel berikut ini.
 |
| Sumber gambar: perikanan.dharmawangsa.ac.id dan omahtani.wordpress.com |
 |
Sumber tabel: Winarsih, et al., 2008
|
Umumnya zat-zat dengan sifat yang berlawanan, seperti asam dam basa cenderung bereaksi satu sama lain. Jadi reaksi asam dengan basa disebut juga penggaraman, karena:
Persamaan berikut menunjukkan apa yang terjadi pada semua ion-ion selama terjadi reaksi penetralan. Reaksi penetralan berguna bagi manusia, antara lain:
- Produksi asam lambung (HCl) yang berlebihan dapat dinetralkan dengan menggunakan senyawa basa Mg(OH)2, sehingga pada saat orang mengalami sakit maag maka orang tersebut mencari aspirin untuk menghilangkan sakit maag. Sakit maag terjadi akibat produksi asam lambung yang berlebihan (HCl).
- Para petani menggunakan reaksi penetralan agar tanah yang terlalu asam dan tidak baik bagi tanaman dapat menjadi netral dengan menambahkan senyawa basa Ca(OH)2 atau air kapur. Ketika sawah akan ditanami palawija biasanya ditaburi dulu dengan kapur dengan maksud tanah yang terlalu asam akan menjadi netral karena bereaksi dengan kapur, kapur bersifat basa. Diharapkan keasaman tanah berkurang.
- Pasta gigi mengandung basa berfungsi untuk menetralkan mulut kita dari asam, yang dapat merusak gigi dan menimbulkan bau mulut. Asam pada mulut terjadi akibat kita makan sayuran (asam askorbat) dan produksi asam lambung (asam klorida).
- Menghilangkanbau amis pada ikan dengan cara menambahkan cuka.
 03.56
03.56
 Unknown
Unknown
Zat Melepaskan Kalor pada Saat Mengembun
Kamu telah mengetahui bahwa pada saat menguap, zat membutuhkan kalor. Bagaimanakah jika proses tersebut berlangsung sebaliknya? Untuk mengetahuinya, dapat dilakukan dengan cara mengisi gelas dengan air panas, kemudian diamkan beberapa saat lalu lihatlah di balik tutup gelas tersebut. Apa yang terjadi?
Di balik tutup gelas terdapat titik-titik air hasil pengembunan. Hal tersebut terjadi karena beberapa molekul air panas yang berupa gas mengalami pendinginan. Perlahan-lahan gas tersebut berubah wujud menjadi cair yang berupa tetesan-tetesan air. Kalor pada uap (gas) terlepas sehingga gerak molekul yang semula cepat berubah menjadi lambat. Akibatnya, uap air menjadi cair. Adanya proses pendinginan (penurunan suhu) pada pengembunan menunjukkan zat melepaskan kalor.
Zat Membutuhkan Kalor untuk Menguap
Kamu telah mengetahui bahwa kalor dapat mengubah wujud zat. cara untuk membuktikan bahwa pada saat menguap zat membutuhkan kalora dalah dengan meneteskan spritus di tangan.
Pada saat spiritus diteteskan, tanganmu akan terasa dingin karena spiritus cepat menguap. Penguapan terjadi karena molekul-molekul zat meninggalkan permukaannya. Penguapan zat membutuhkan kalor. Kalor yang diperlukan spiritus untuk menguap diambil dari kulit tanganmu sehingga tangan terasa dingin. Untuk lebih memperkuat pemahamanmu bahwa pada penguapan dibutuhkan kalor, kita contohkan pada saat memasak air.
Pada saat memasak air dapat diamati bahwa pemanasan akan mengakibatkan molekul-molekul zat cair melepaskan diri dari permukaaan zat cair. Proses ini dinamakan dengan penguapan, yaitu proses perubahan wujud zat cair menjadi gas. Ini menunjukkan bahwa penguapan membutuhkan kalor.
Pembahasan materi mengenai kalor telah selesai. Untuk menguji pemahaman anda, dapat menjawab kuis berikut ini....
Pembahasan materi mengenai kalor telah selesai. Untuk menguji pemahaman anda, dapat menjawab kuis berikut ini....
 03.50
03.50
 Unknown
Unknown
Kalor Lebur
Semakin banyak massa suatu zat, semakin besar pula kalor yang diperlukan untuk meleburkannya. Hal tersebut menunjukkan bahwa kalor yang diperlukan untuk meleburkan suatu zat bergantung pada massanya.
Apakah kalor yang diperlukan untuk meleburkan zat juga bergantung pada jenisnya? Telah dilakukan percobaan peleburan antara alkohol beku dan es dengan massa yang sama. Diperoleh bahwa kalor yang diperlukan oleh es untuk melebur lebih besar dibandingkan kalor yang diperlukan alkohol.
Hal ini menunjukkan bahwa kalor yang diperlukan untuk melebur bergantung pada jenis zat. Setiap jenis zat memiliki kalor lebur yang berbeda-beda. Kalor lebur adalah kalor yang diperlukan oleh 1 kg zat untuk mengubah wujudnya dari padat menjadi cair pada titik leburnya. Titik lebur adalah suhu suatu zat pada saat zat mulai mencair.
Adapun kalor yang dilepaskan oleh 1 kg zat untuk membeku pada titik bekunya disebut kalor beku. Besarnya kalor beku sama dengan kalor lebur dan titik bekunya sama dengan titik leburnya. Secara matematis, dituliskan sebagai berikut.
Q = m . L
dengan:
Q = jumlah kalor yang diperlukan (J)
m = massa zat (kg)
L = kalor lebur (J/kg)
Suatu percobaan telah dilakukan untuk mendapatkan titik lebur dan kalor lebur beberapa jenis zat, seperti pada berikut.
Kalor yang Dibutuhkan untuk Mendidihkan Zat Bergantung pada Massa dan Jenis Zat
Semakin banyak massa zat, semakin lama untuk mendidihkannya. Hal ini disebabkan banyak partikel zat yang harus diubah menjadi gas sehingga semakin banyak kalor yang diberikan untuk mendidih. Apakah untuk mendidihkan zat yang berbeda memerlukan jumlah kalor yang berbeda pula?
Air memiliki titik didih yang lebih besar dibandingkan dengan alkohol. Jadi, air lebih banyak membutuhkan kalor daripada alkohol untuk mencapai suhu tertentu. Seperti yang telah dibahas sebelumnya bahwa kalor sebanding dengan massa benda. Begitu pula kalor yang digunakan untuk mendidihkan suatu zat akan sebanding dengan massa zat tersebut. Selain itu, kalor yang digunakan untuk mendidihkan suatu zat bergantung pada jenis zat tersebut. Jenis zat ini akan menentukan titik didihnya, yaitu suhu di mana suatu zat berubah wujud dari zat cair menjadi gas pada tekanan 1 atm.
Titik didih suatu zat sama dengan titik embunnya, yaitu di mana terjadi proses pengembunan atau perubahan wujud dari gas menjadi cair. Banyaknya kalor yang dibutuhkan untuk menguapkan 1 kg zat pada titik didihnya disebut kalor uap (U). Besar kalor uap selalu sama dengan kalor embun, yakni kalor yang diperlukan untuk mengembunkan 1 kg zat gas.
Secara matematis, hubungan antara kalor yang di butuhkan untuk mendidihkan suatu zat dengan massanya ditulis sebagai berikut.
Q = m . U
dengan: Q = banyaknya kalor yang diperlukan (J)
m = massa zat (kg)
U = kalor uap (J/kg)
Dari hasil percobaan, diperoleh beberapa titik didih zat cair yang diperlihatkan pada berikut.
Tabel tersebut memperlihatkan bahwa zat yang berbeda memiliki titik didih yang berbeda pula. Di antara berbagai jenis zat cair, air memiliki titik didih yang relatif besar daripada zat cair lainnya sehingga air sering digunakan sebagai pendingin benda-benda yang memiliki titik didih di atas 100°C.
Pembahasan materi mengenai kalor telah selesai. Untuk menguji pemahaman anda, dapat menjawab kuis berikut ini....
Zat Melepaskan Kalor pada Saat Mengembun
Kamu telah mengetahui bahwa pada saat menguap, zat membutuhkan kalor. Bagaimanakah jika proses tersebut berlangsung sebaliknya? Untuk mengetahuinya, dapat dilakukan dengan cara mengisi gelas dengan air panas, kemudian diamkan beberapa saat lalu lihatlah di balik tutup gelas tersebut. Apa yang terjadi?
Di balik tutup gelas terdapat titik-titik air hasil pengembunan. Hal tersebut terjadi karena beberapa molekul air panas yang berupa gas mengalami pendinginan. Perlahan-lahan gas tersebut berubah wujud menjadi cair yang berupa tetesan-tetesan air. Kalor pada uap (gas) terlepas sehingga gerak molekul yang semula cepat berubah menjadi lambat. Akibatnya, uap air menjadi cair. Adanya proses pendinginan (penurunan suhu) pada pengembunan menunjukkan zat melepaskan kalor.
Zat Membutuhkan Kalor untuk Menguap
Kamu telah mengetahui bahwa kalor dapat mengubah wujud zat. cara untuk membuktikan bahwa pada saat menguap zat membutuhkan kalora dalah dengan meneteskan spritus di tangan.
Pada saat spiritus diteteskan, tanganmu akan terasa dingin karena spiritus cepat menguap. Penguapan terjadi karena molekul-molekul zat meninggalkan permukaannya. Penguapan zat membutuhkan kalor. Kalor yang diperlukan spiritus untuk menguap diambil dari kulit tanganmu sehingga tangan terasa dingin. Untuk lebih memperkuat pemahamanmu bahwa pada penguapan dibutuhkan kalor, kita contohkan pada saat memasak air.
Pada saat memasak air dapat diamati bahwa pemanasan akan mengakibatkan molekul-molekul zat cair melepaskan diri dari permukaaan zat cair. Proses ini dinamakan dengan penguapan, yaitu proses perubahan wujud zat cair menjadi gas. Ini menunjukkan bahwa penguapan membutuhkan kalor.
Pembahasan materi mengenai kalor telah selesai. Untuk menguji pemahaman anda, dapat menjawab kuis berikut ini....
Langganan:
Postingan (Atom)
 RSS Feed
RSS Feed Twitter
Twitter












